 来源:
来源:
 2024-12-10
2024-12-10
 277
277
抗体已成为当代生物医药重点组成部分,而在抗体药物研发生产过程中,一种打破传统,更高通量、更快速的抗体滴度检测、错配分析、聚集程度检测、糖基化分析、表面疏水性检测、表面电荷检测、多特异性检测及胞饮作用检测方法的应用,将进一步提高抗体行业的发展。
01 PAIA Biotech 微孔板技术原理
我们以高通量抗体滴度筛选试剂盒为例,来进行PAlA Biotech的系列检测试剂盒原理说明。
PAlA Biotech在中间突起的孔里预先加入微球,微球上带有Fc结构。由于微孔板中间突起,因此在重力作用下微球位于孔板底部。向微孔中加入带有荧光集团的proteinA,然后加入样本,并进行混匀。样本中的抗体分子会和带有荧光集团的proteinA结合,并存在溶液中。而未被样本中抗体结合的proteinA分子将被带有Fc结构的微球结合,并沉淀于微孔底部。
透过微孔板底部进行荧光分析,基于荧光值的大小即可判定样本中抗体滴度的大小。
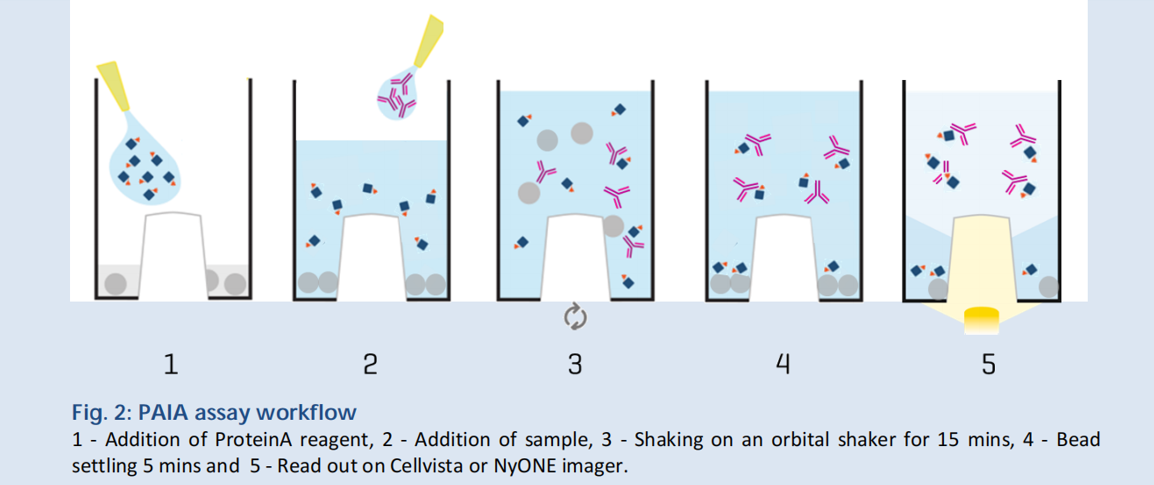
基于此原理,PAlA Biotech还开发了抗体错配分析、聚集程度检测、糖基化分析、表面疏水性检测、表面电荷检测、多特异性检测及胞饮作用检测系列试剂盒。这些基于微孔法的检测试剂盒,相对于传统的检测方法,通量更大、检测速度更快,并且可以兼容自动化系统,节省更多人力成本。
02 PAIA Biotech 产品应用介绍
一、检测原理:如上文介绍
二、传统抗体检测方法:
1 酶联免疫吸附测定(ELISA)
● 原理:利用抗原-抗体的特异性结合,结合酶标二抗和显色反应,通过比色法检测抗体浓度
● 优点:灵敏度高,适用于低浓度的抗体检测
● 缺点:操作步骤繁琐,耗时长,洗涤和孵育时间较长,且结果易受实验人员操作的影响,难以实现高通量
2 高成效液相色谱 (HPLC) - 蛋白A亲和色谱
● 原理:使用Protein A亲和色谱柱,通过抗体的Fc区与Protein A的结合特性分离和定量抗体
● 优点:灵敏度高,特异性强,尤其适用于纯化过程中的抗体浓度检测
● 缺点:设备昂贵,操作复杂,检测周期长,无法高通量操作
3 表面等离子共振(SPR)
● 原理:利用表面等离子共振技术,实时监测抗原-抗体结合的动力学变化,从而定量检测抗体滴度
● 优点:可实时监测,数据稳定,能够测定结合动力学参数
● 缺点:设备昂贵,操作复杂,样品用量大,难以高通量处理
4 电泳 / Western Blot
● 原理:通过SDS-PAGE分离蛋白质,然后用抗体与蛋白结合,并通过化学发光或显色系统检测抗体的存在
● 优点:可分析抗体的分子量和结构信息,操作方法成熟
● 缺点:无法准确定量,操作耗时,灵敏度不高,重复性差,难以高通量检测
5 紫外-可见分光光度计(UV-Vis)
● 原理:通过在 280 nm 处检测抗体溶液的吸光度(A280)来定量蛋白质浓度
● 优点:快速、简单、无损伤,适用于大范围的在线监测
● 缺点:特异性差,无法区分抗体与其他蛋白质,难以高通量操作
6 毛细管电泳(CE-SDS)
● 原理:通过电泳分离蛋白质,结合SDS,定量检测抗体浓度
● 优点:高分辨率,可同时检测抗体的纯度和分子量
● 缺点:仪器昂贵,操作复杂,无法高通量检测
三、PAIA biotech与传统方法的对比总结
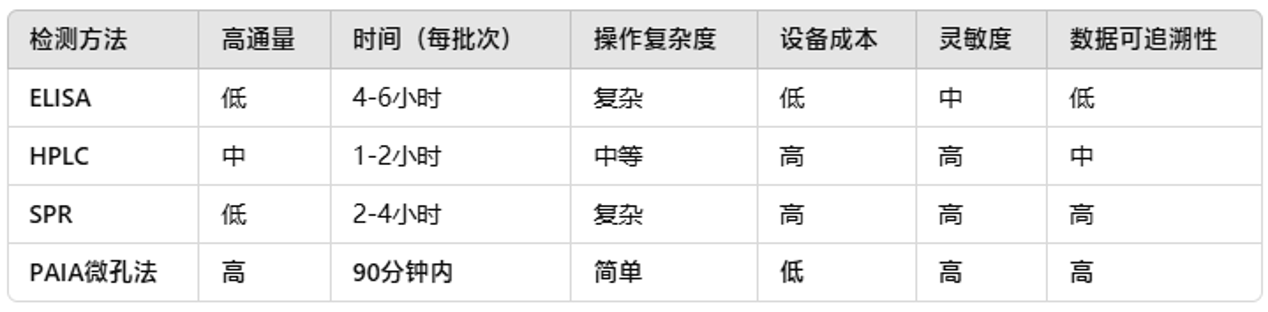
总的来说,其与传统方法相比,更快、更简便、更高效,尤其适用于规模生产和GMP环境中的批量检测。
一、检测原理:
同样基于中间突起的微孔板,将样品(如抗体或糖蛋白)加入PAIA的微孔板中,孔内预包被了特异性糖结合分子(如凝集素),这些分子可特异性识别并结合到目标糖基(如甘露糖、半乳糖、唾液酸等)上。加入标记了荧光的二抗或其他荧光探针,特异性识别与目标糖基结合的分子。利用荧光读板仪读取荧光信号,荧光强度与样品中糖基的丰度呈正相关。
二、传统糖基化检测方法:
1 高成效液相色谱-糖肽分析
(HPLC-Glycan Profiling)
● 原理:先对抗体进行酶解,释放出N-糖或O-糖后,使用荧光标记法标记糖基,再通过HPLC分离糖基,并检测其荧光信号
● 优点:可以准确分析和定量目标糖基的组成和丰度,分离度高
● 缺点:流程繁琐,操作复杂,通常需要1-2天才能完成,成本高,无法高通量处理
2 质谱检测 (LC-MS/MS, MALDI-TOF-MS)
● 原理:将抗体的糖基分离后,采用**液相色谱-质谱联用(LC-MS/MS)或基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)**检测糖基的质量和序列
● 优点:可以提供高分辨率的糖基结构信息,能够区分同分异构体,精确度高
● 缺点:设备昂贵,技术要求高,数据解析复杂,无法大规模高通量筛选,检测周期长(通常2-3天)
3 毛细管电泳 (CE-LIF) - 荧光标记糖基法
● 原理:将糖基通过荧光标记后,利用毛细管电泳在电场中分离糖分子,使用激光诱导荧光(LIF)检测信号
● 优点:灵敏度高,分析速度快,分离度高
● 缺点:设备成本高,方法复杂,通常需要1天或更长时间,无法高通量操作
4 凝集素芯片(Lectin Array)
● 原理:利用凝集素(如ConA、WGA等)对糖基的特异性识别和结合,将这些凝集素固定在芯片上,通过荧光检测样品中的糖基化特征
● 优点:能够多重检测多种糖基化修饰,并可一次性分析多个样品中的多种糖基类型
● 缺点:设备和试剂成本高,数据解释复杂,灵敏度低于质谱,无法量化特定的糖基数量
5 ELISA方法
(Enzyme-Linked Lectin Assay, ELLA)
● 原理:在ELISA板中包被目标糖基,加入抗体,随后通过特异性抗糖基抗体和酶联反应显色,最终通过比色法检测样品中糖基的含量
● 优点:方法成熟、成本低、特异性高,适用于定量检测
● 缺点:灵敏度较低,无法检测低丰度糖基修饰,操作流程复杂,检测时间长(4-6小时),且难以高通量
三、PAIA biotech与传统方法的对比总结
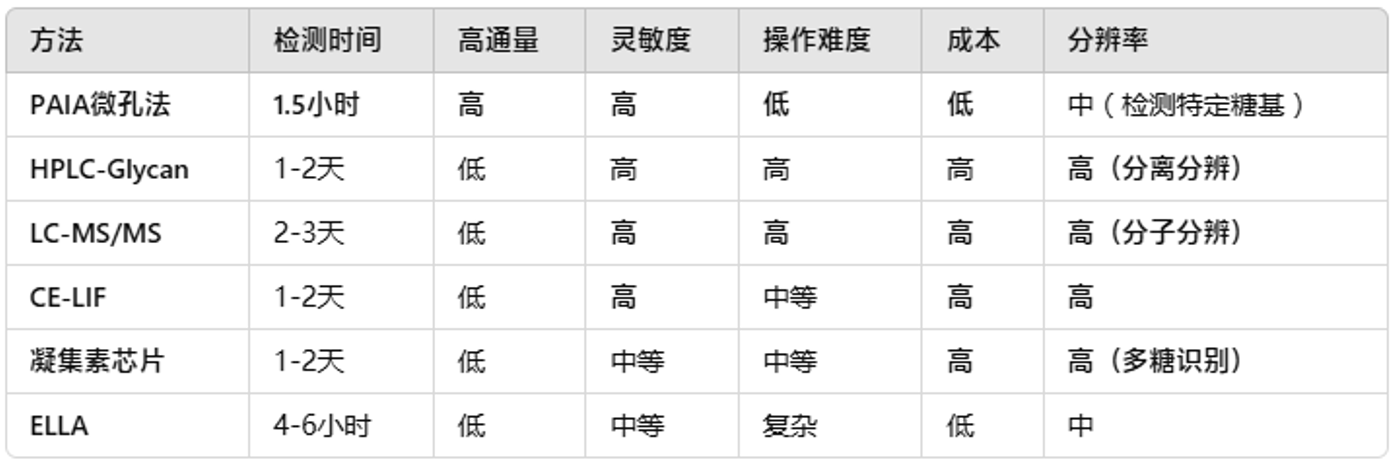
总的来说,PAIA的微孔系统通过高通量、快速和免洗的检测技术,在糖基化检测中表现优异。与HPLC、质谱和毛细管电泳等传统方法相比,PAIA的速度更快、成本更低、操作更简单,尤其适用于生产环境和规模筛选。



更多详情,欢迎扫码咨询