 来源:
来源:
 2024-12-24
2024-12-24
 358
358
PAlA Biotech基于其专有微孔板技术开发的系列检测试剂盒推出系列产品。具体原理如下:
通过在中间突起的孔里预先加入微球。由于微孔板中间突起,因此在重力作用下微球位于孔板底部。向微孔中加入带有荧光集团的分子和待检测样本,并进行混匀。样本中的目标分子和荧光集团结合,与此同时微球和目标分子竞争荧光集团。
透过微孔板底部进行荧光分析,基于荧光值得大小即可判定样本中目标分子的多少。
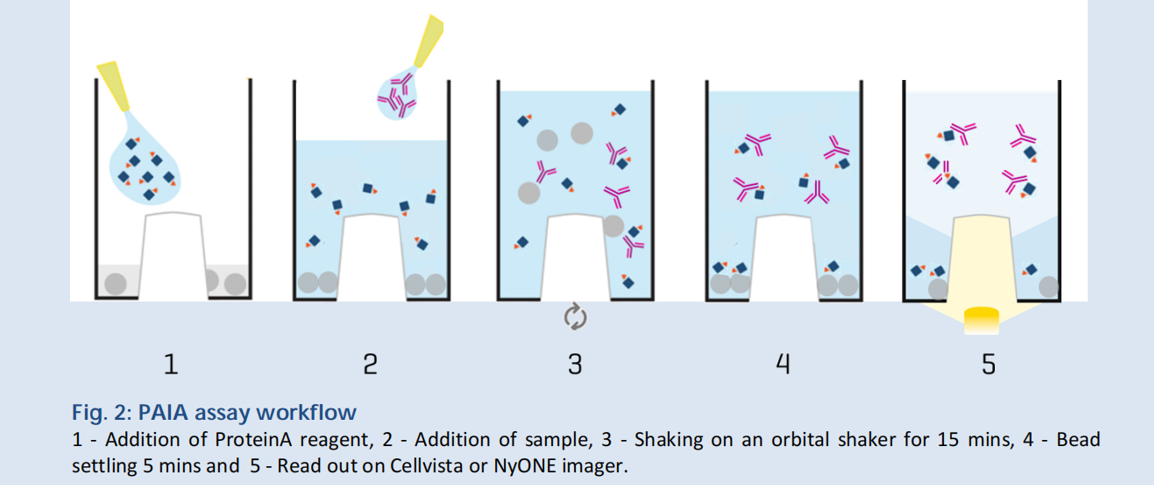
上期给大家介绍了PAIA Biotech系列试剂盒是两大应用场景:抗体滴度检测及糖基化分析(点击可查看详情),本期将继续为大家介绍PAlA Biotech系列试剂盒在抗体错配分析、聚集程度检测、表面疏水性检测、表面电荷检测、多特异性检测、胞饮作用检测中的应用。
01 原理分析
在生物制药和抗体药物开发过程中,抗体错配(mismatch)是一个常见的问题,尤其在抗体筛选、生产和质控阶段。
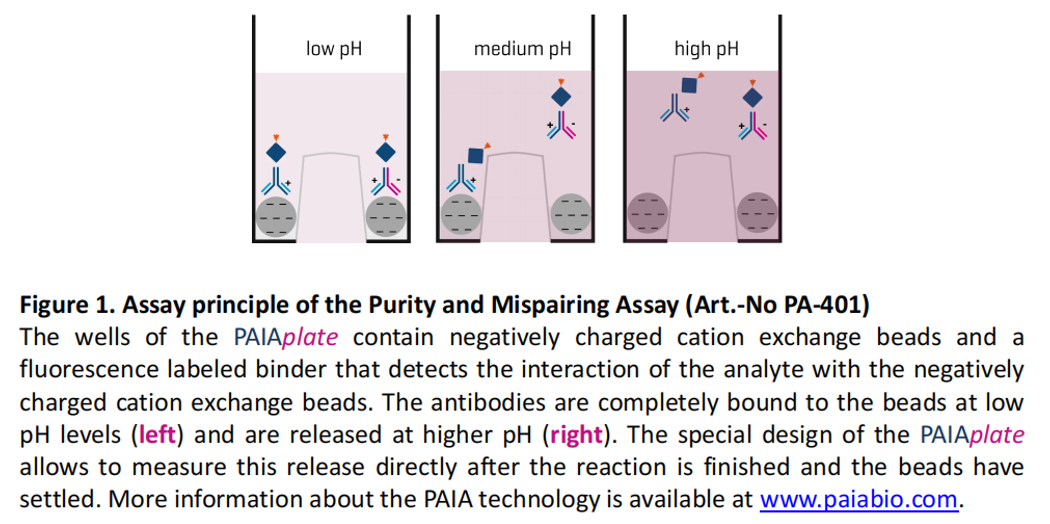
PAIA Biotech的试剂盒,同样借助中间突起的微孔板,基于在不同的PH的情况下,错配和正确配对的抗体,他们对离子交换磁珠的结合能力是不同的为原理,因此会显示出不同的荧光读数量,依次判定样本中抗体的错配情况。
02 传统的抗体错配检测方法
传统方法主要包括ELISA(酶联免疫吸附法)、HPLC(高效液相色谱法)和SPR(表面等离子共振法)等技术。每种方法的检测原理和操作流程各不相同,具体如下:
1 ELISA(酶联免疫吸附法)
1. 原理:ELISA利用抗原-抗体的特异性结合反应,在微孔板上对抗体的结合能力进行检测。通常,靶抗原会被固定在微孔板的底部,当加入抗体样品后,特定的抗体会与抗原结合。为了检测这种结合反应,加入与抗体结合的标记二抗(通常是HRP标记的二抗)。通过加入底物(如TMB溶液)并在特定条件下显色,显色强度与结合的抗体数量成正比
2. 操作流程:包被抗原 → 封闭 → 加入样品 → 加入二抗 → 显色反应 → 终止反应 → 读板检测
3. 优点:灵敏度高、操作设备简单,适用于大规模样品筛选和质控检测
4. 缺点:操作步骤繁琐,检测时间较长(3-5小时),需要多次洗涤,容易出现假阳性或假阴性
2 HPLC(高效液相色谱法)
1. 原理:HPLC是一种基于分子尺寸、极性或电荷差异的分离检测技术。样品在高压泵的推动下通过固定相填充的色谱柱,不同成分因物理化学特性的不同,在色谱柱中被分离。HPLC可以分离和检测不同的抗体亚型、抗体聚集体和杂质等,从而区分抗体错配现象
2. 操作流程:样品前处理 → 进样 → 通过色谱柱分离 → 通过检测器检测(如紫外/荧光检测器) → 数据记录与分析
3. 优点:灵敏度高,适用于检测抗体分子量、纯度、聚集体及其结构差异
4. 缺点:操作复杂,样品前处理繁琐,检测时间较长(2-4小时),设备成本高,难以实现高通量检测
3 SPR(表面等离子共振法)
1. 原理:SPR是一种实时监测分子间相互作用动力学的技术,基于光在金属界面反射时的表面等离子体共振现象。检测时,将一种分子(如抗原)固定在金属表面,另一种分子(如抗体)通过流动样品与之结合。分子结合引起表面折射率的变化,SPR传感器记录到的共振角变化与分子结合的数量成正比,从而监测到结合的抗体
2. 操作流程:抗原固定 → 流动样品(抗体)注入 → 动态实时监测分子结合情况 → 数据记录与分析
3. 优点:实时检测、动态监测,灵敏度高,能提供结合动力学数据(如Ka、Kd)
4. 缺点:设备昂贵,操作复杂,样品用量大,难以高通量处理
03 PAIA Biotech检测试剂盒与传统方法的对比总结
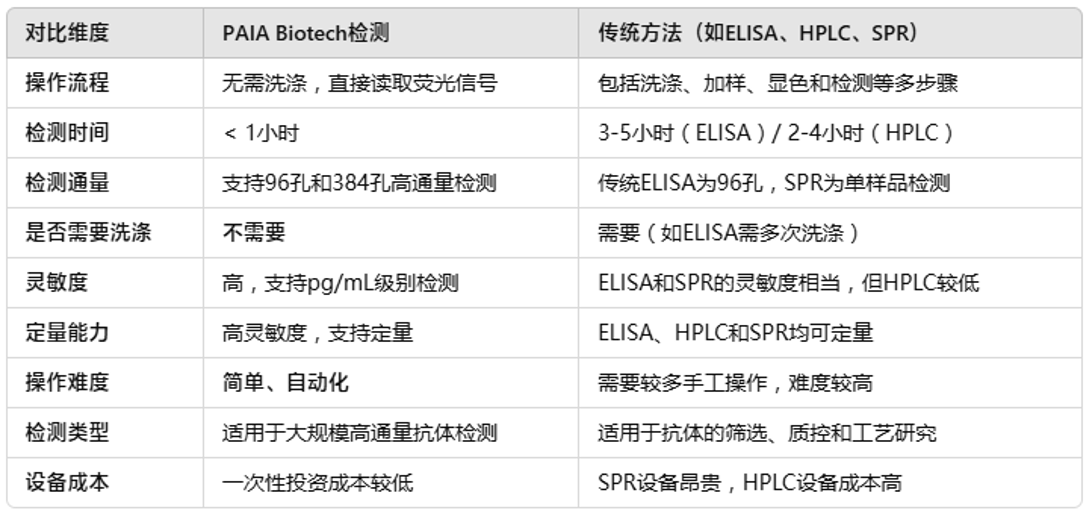
总的来说,PAIA Biotech的检测技术在高通量、快速、简单操作等方面具有较大优势,特别适合用于大规模的抗体错配检测。与传统的ELISA和HPLC方法相比,PAIA检测大大缩短了检测时间,降低了操作复杂性,并且对高通量的抗体筛选和生产环境更加友好。
抗体聚集体的产生可能会影响药物的安全性、稳定性和有效性。抗体药物开发,质量控制(QC),工艺优化流程都需要进行抗体聚集检测分析。
01 原理分析
PAIA Biotech的抗体聚集检测采用了荧光微孔板检测技术,其核心原理是利用特异性配体(如捕获抗体或结合分子)在微孔板中捕获抗体聚集体,并通过荧光标记的二抗对其进行可视化检测。将抗体样品加入特定配体包被的微孔板中,聚集体会优先与捕获分子结合,入荧光标记的二抗,二抗与捕获的抗体聚集体结合,产生可检测的荧光信号,荧光检测仪对每个孔的荧光强度进行读取,荧光强度的高低与抗体聚集体的数量成正比。
02 传统的抗体聚集分析方法及其局限性
传统的抗体聚集检测方法主要包括SEC-HPLC(凝胶过滤色谱法)、DLS(动态光散射)和AUC(分析超速离心)等。这些方法的原理和检测特点如下:
1 SEC-HPLC(凝胶过滤色谱法)
1. 原理:SEC-HPLC利用抗体分子的分子大小差异进行分离,较大的分子(聚集体)会更早从色谱柱中流出,而较小的单体则滞后流出,从而实现分离和检测
2. 局限性:
● 检测速度慢,通常每个样品检测需要30分钟到1小时
● 样品前处理复杂,需要脱气、过滤等操作,增加了人力成本
● 高压操作可能破坏天然的抗体聚集体,造成检测偏差
2 DLS(动态光散射)
1. 原理:DLS是通过分析样品中颗粒的布朗运动速率,计算出颗粒的粒径分布。抗体聚集体的体积比单体更大,光的散射强度也更高,因此可通过散射信号区分抗体单体和聚集体
2. 局限性:
● 对高浓度样品不敏感,高浓度的蛋白溶液容易引发多重散射效应,导致数据不准确
● 只适用于检测较大的颗粒,无法区分微小的抗体二聚体或寡聚体
● 只能测量体积信息,无法获得抗体的定量信息
3 AUC(分析超速离心)
1. 原理:AUC通过在高离心力下将样品中不同质量的分子分离,抗体单体、二聚体和更高聚集体会分离成不同的带
2. 局限性:
● 检测设备昂贵,操作复杂,通常需要经过专门培训的人员操作
● 检测过程耗时长达6-8小时,不适合高通量分析
● 只能在低样品通量下操作,无法应对大规模样品检测需求
03 PAIA Biotech的抗体聚集检测优势
与传统的抗体聚集分析方法相比,PAIA Biotech的检测方案在速度、成本和通量方面具有显著的优势。
1. 检测速度快:与SEC-HPLC和AUC相比,PAIA检测通常在1小时内完成,可大幅缩短检测时间
2. 高通量检测:PAIA检测平台支持96孔和384孔板,实现批量检测,而SEC-HPLC和AUC只能单样品逐一检测
3. 无需洗涤,自动化程度高:PAIA检测过程不需要洗涤步骤,自动化平台可快速操作,节省人力和时间成本
4. 灵敏度高:可检测到pg/mL级别的抗体浓度,尤其适用于早期药物筛选和大规模质控
5. 简单的设备要求:与SPR和AUC所需的昂贵设备不同,PAIA只需标准的荧光微孔板检测仪,维护成本低、便于操作
04 PAIA Biotech检测试剂盒与传统方法的对比总结
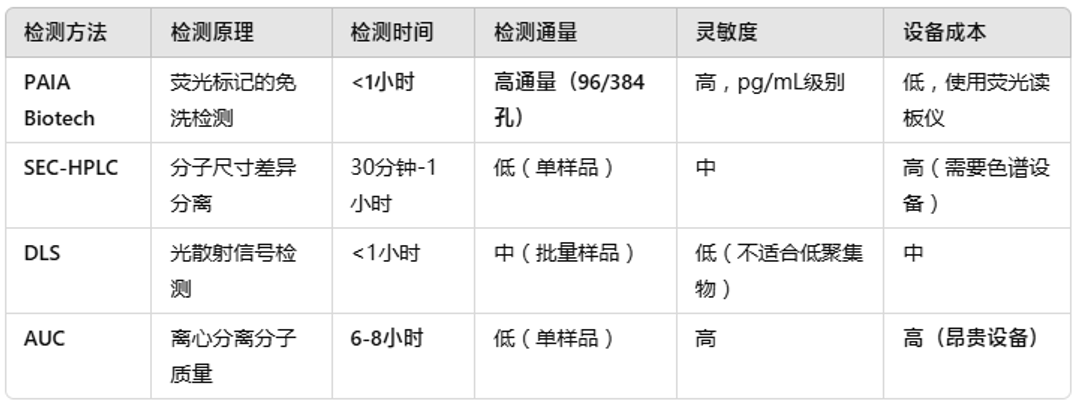
PAIA Biotech同样基于荧光微孔板检测技术,开发了抗体表面疏水性检测,抗体表面电荷检测,抗体多特异性检测,抗体胞饮作用检测系列试剂盒。我们以抗体表面疏水性检测,抗体表面电荷检测为例,进行相关产品介绍。
01 抗体表面疏水性检测
首先在抗体表面疏水性检测方面,抗体表面疏水性的评估对于预测抗体的聚集风险、稳定性和可开发性至关重要。传统的检测方式有反相高效液相色谱(RP-HPLC),表面等离子体共振(SPR),疏水相互作用色谱(HIC, Hydrophobic Interaction Chromatography)等。与传统方式相比,PAIA biotech产品具有如下优点:
1. 高通量:
● 支持96孔/384孔板操作,一次可同时检测数十至上百个抗体样品
● 与传统的HPLC、SPR、HIC方法相比,检测速度更快,适合大规模的抗体库筛选
2. 快速检测,1小时内完成:
● 传统HPLC和HIC方法需要几个小时,而PAIA方法在1小时内即可完成检测,节省时间成本
3. 无需复杂仪器,操作简单:
● 不需要使用HPLC、SPR等昂贵的精密仪器,只需普通的荧光检测仪,大大降低了设备和维护成本
4. 无洗涤操作,节省人力:
● 传统的疏水性检测(如HIC)需要多步洗涤和洗脱,而PAIA的检测方案不需要洗涤操作,大大减少了操作步骤和人工干预
5. 检测灵敏度高,结果稳定:
● 与传统的ANS荧光染料法相比,PAIA的荧光标记技术更加敏感,能够检测到更小的疏水性差异,结果可重复性更高
6. 样品用量少,节约成本:
● PAIA的检测中,每孔的样品需求量非常少(仅需10-50 μL),与SPR和HIC等高样品需求的传统技术形成对比,降低了检测成本
7. 适合抗体开发中的早期筛选:
● 在候选抗体的开发过程中,PAIA的高通量检测能力帮助筛选疏水性较低的抗体变体,减少后续的聚集风险
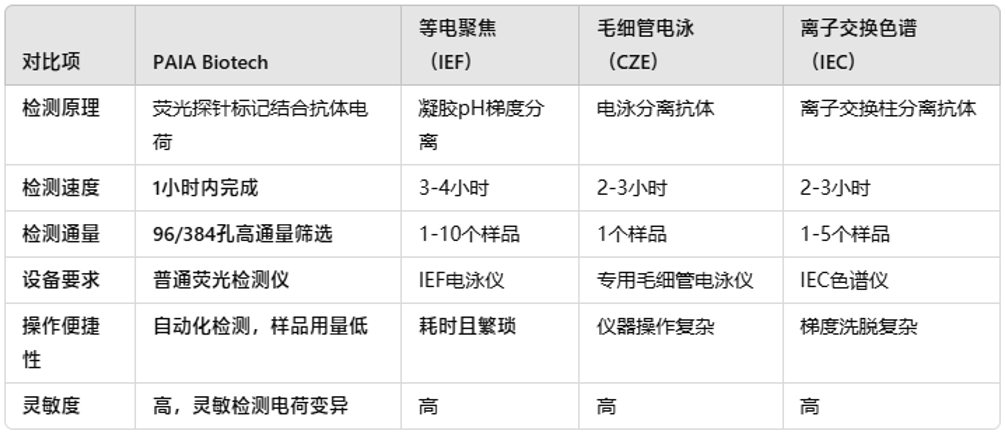
02 抗体表面电荷检测
抗体表面电荷检测方面,抗体表面电荷同样是影响抗体稳定性、可溶性和药代动力学特性的关键因素。电荷的变化可能导致聚集、吸附和效价下降。
03 PAIA Biotech检测试剂盒与传统方法的对比总结



更多详情,欢迎扫码咨询