 来源:
来源:
 2026-01-29
2026-01-29
 777
777
使用eProtein Discovery系统快速无细胞表达和纯化VEGF165,并使用Biacore系统验证其活性
传统的蛋白质优化与获取方法往往耗时数周甚至数月,尤其当表达出的蛋白质出现不溶、折叠异常或失去活性等问题时,研究人员还需用新构建体对蛋白质优化流程进行多次重复操作。这不仅令人倍感挫败,更会造成高昂的成本消耗与大量的时间浪费。
我们整合了两款前沿生命科学工具,形成一套提效解决方案:通过eProtein Discovery系统实现蛋白质的快速获取,借助Biacore SPR系统开展蛋白质间相互作用研究,以此验证蛋白质的功能活性。我们以一种难以表达且已知含有二硫键的蛋白质——血管内皮生长因子165(VEGF165)为例,展示该系统的工作流程。
1️⃣利用eProtein Discovery系统进行蛋白表达&纯化筛选及规模放大
eProtein Discovery系统是一个集成化系统,仅需3个简单步骤即可实现蛋白质的快速获取(图1)。
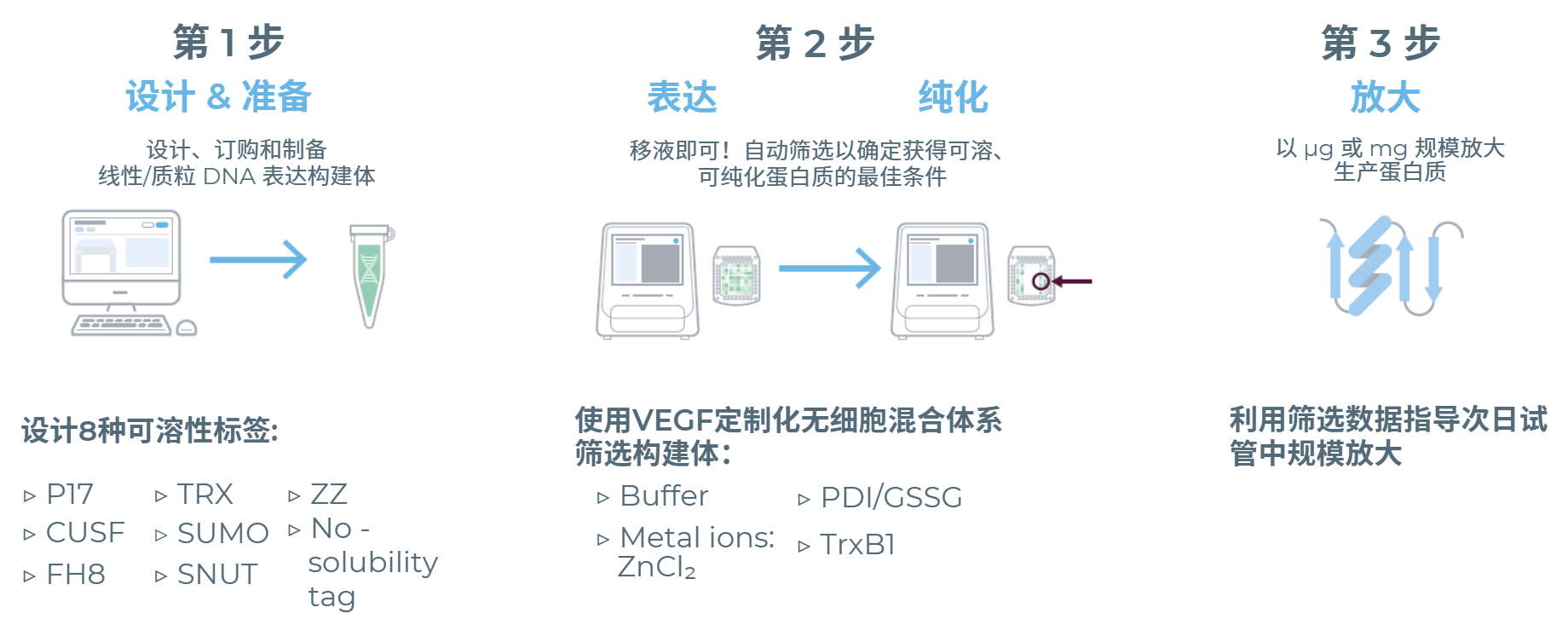
图1:eProtein Discovery工作流程

图2:eProtein Discovery 卡盒筛选采用荧光互补技术检测可溶性蛋白的表达
2️⃣Biacore检测
Biacore SPR系统借助表面等离子体共振(SPR)现象,能够实时监测生物分子之间的相互作用。在科研、药物研发、质量控制及生产制造领域,Biacore SPR系统是一款功能强大的工具,可提供诸如动力学、亲和力、浓度及特异性等方面的数据。本研究中,我们使用Biacore 1S+ SPR系统(图3),通过蛋白质间相互作用研究,探究VEGF165与贝伐珠单抗之间的相互作用。

图3 Biacore 1S+ SPR系统配备有6个流动池,这些流动池既可单独使用,也可组合使用,从而提高分析的灵活性
Biacore单循环动力学(SCK)用于研究VEGF165与贝伐珠单抗的结合动力学。将浓度依次为0.78、1.56、3.125、6.25、12.5和25 nM的VEGF165,注射到固定有贝伐珠单抗(捕获于Protein A传感器芯片上)的体系中。
Biacore SCK方法详情如下:贝伐珠单抗捕获水平为75 RU,结合时间120秒,解离时间3600秒,流速30 μL/分钟,温度25°C,运行缓冲液为PBS-P+。实验数据采用1:1结合模型进行拟合,以推导结合常数。
1️⃣通过该仪器进行的表达与纯化筛选,能够确定可产生最高纯化产量的构建体与无细胞混合体系组合
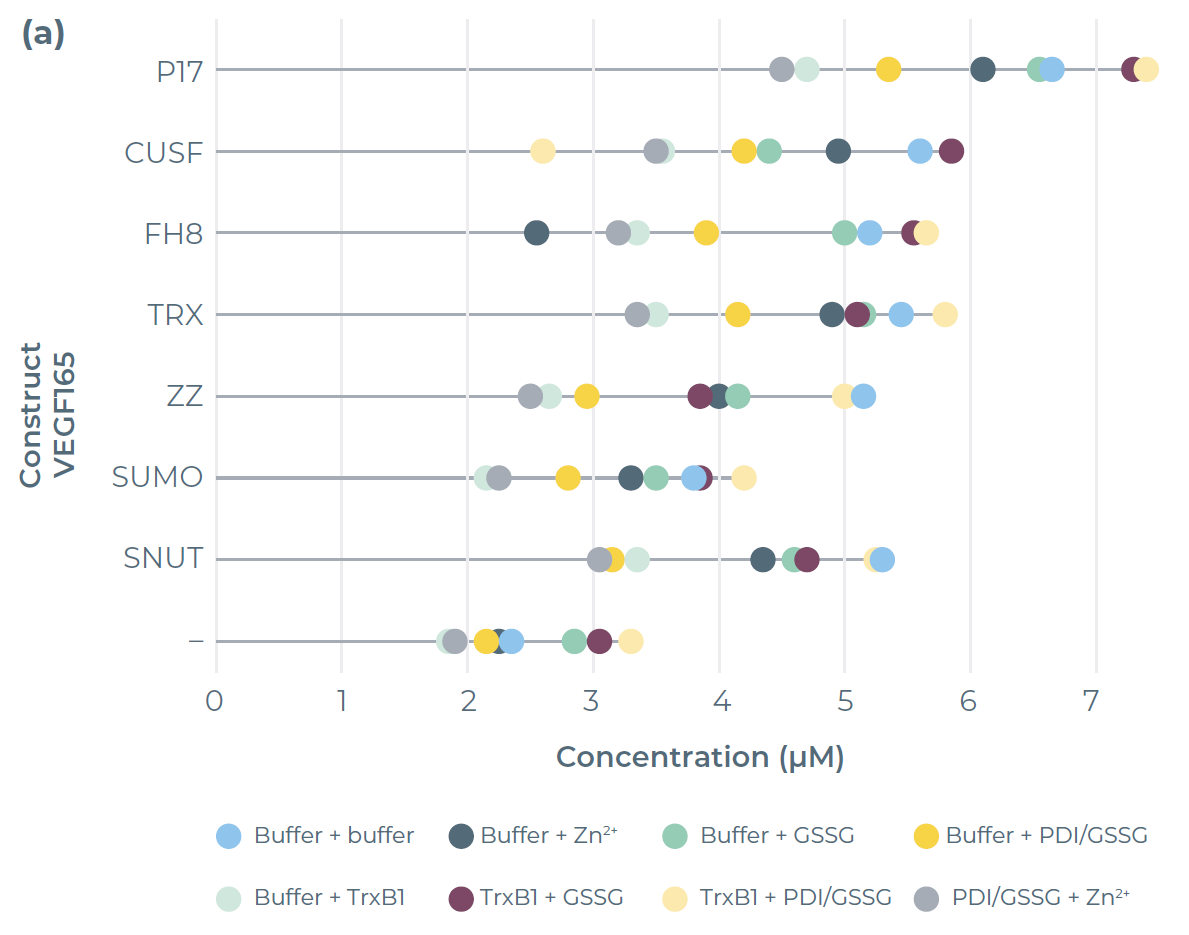
图4.1:表达及纯化结果。(a) 棒棒糖图显示了在不同无细胞混合体系中表达的VEGF165变体的表达量
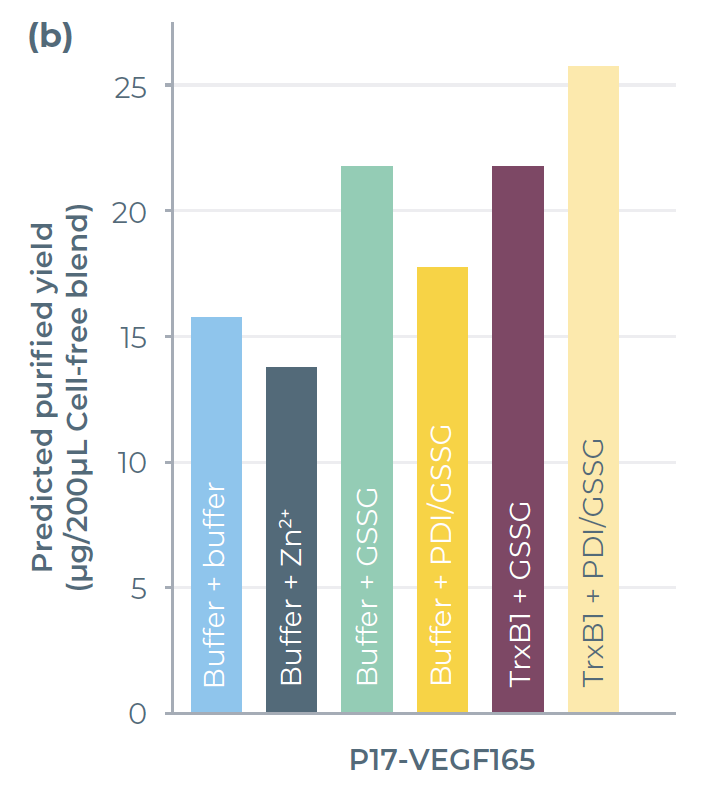
图4.2:表达及纯化结果。(b) 卡盒预测的放大产量,可辅助放大规划
VEGF165的最高表达量是在P17标签构建体、伴侣蛋白(TrxB1)及氧化条件(PDI/GSSG混合物)共同作用下实现的(图4)。该组合通过P17可溶性融合标签的存在,以及支持二硫键形成的添加剂,促进了蛋白质的可溶性表达。这一结果与已发表的研究一致,即VEGF在带有可溶性融合标签且有助于二硫键形成的大肠杆菌菌株中能良好表达。
2️⃣放大表达可生成高产量、高纯度的 VEGF165

图5:P17-VEGF165的放大表达与纯化结果显示,从1mL无细胞混合体系中可获得106μg的可溶性蛋白,且纯度较高
3️⃣Biacore检测证实了VEGF165能与贝伐珠单抗发生功能性结合
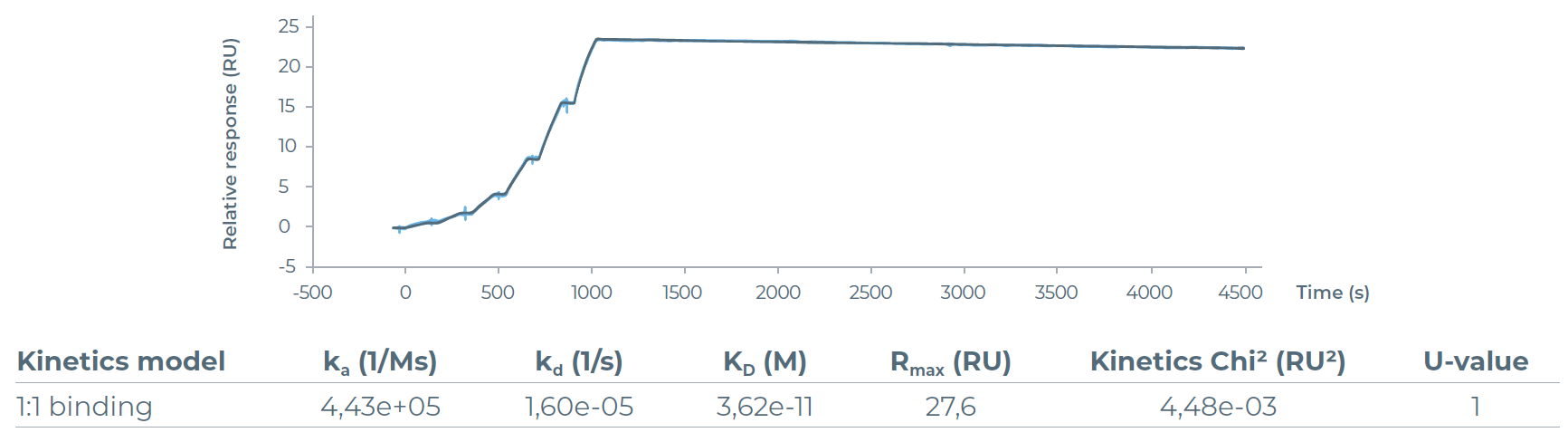
图6:传感器图(蓝色曲线)及1:1拟合曲线(黑色曲线),展示了在Protein A传感器芯片捕获的贝伐珠单抗上,VEGF165的Biacore单循环动力学(SCK)检测结果。表格呈现了这些相互作用的动力学参数。Biacore检测证实了VEGF165的功能活性,其亲和常数(KD)为36 pM
*从DNA到106 μg纯化蛋白的时间不到48小时
*Biacore检测证实VEGF165与贝伐珠单抗结合具有功能活性,亲和力达36pM
通过eProtein Discovery系统进行快速无细胞蛋白表达与纯化筛选,次日即可进行蛋白放大生产,这一组合显著缩短了获取高质量蛋白以在Biacore系统上进行功能验证的时间。
以上文章来源于曼博生物,作者Nuclera官方代理