 来源:
来源:
 2026-01-29
2026-01-29
 1162
1162

糖尿病是一种以高血糖为特征的代谢性疾病,主要发病机制是胰岛素分泌不足或胰岛素抵抗所导致的葡萄糖代谢紊乱。目前,全球糖尿病患者总数已超过5.37亿,预计到2045年将增长至7.83亿,增幅高达46%。
根据患者的发病机制、临床特点,糖尿病主要又分为I型糖尿病(Type I Diabetes Mellitus,T1DM)和II型糖尿病(Type II Diabetes Mellitus,T2DM)。
I型糖尿病是由于胰岛β细胞遭受自身免疫系统破坏导致胰岛素分泌不足,从而引起的血糖升高,患者需要依赖外源胰岛素的治疗方式补充体内缺乏的胰岛素剂量以维持血糖稳定。
II型糖尿病是最常见的糖尿病类型,占糖尿病患者的90%以上。II型糖尿病主要表现为胰岛素抵抗(insulin resistance,即身体对胰岛素敏感性降低)和胰岛素分泌不足,由于胰岛素不能有效地将血糖转移到细胞内而引起的血糖升高。
此外,糖尿病还包括妊娠糖尿病,继发性糖尿病、胰腺疾病引起的糖尿病、药物引起的糖尿病(如类固醇药物引起的糖尿病)、单基因糖尿病等类型,这些疾病通常是由于基因突变、内分泌紊乱、药物或化学品等因素引起。
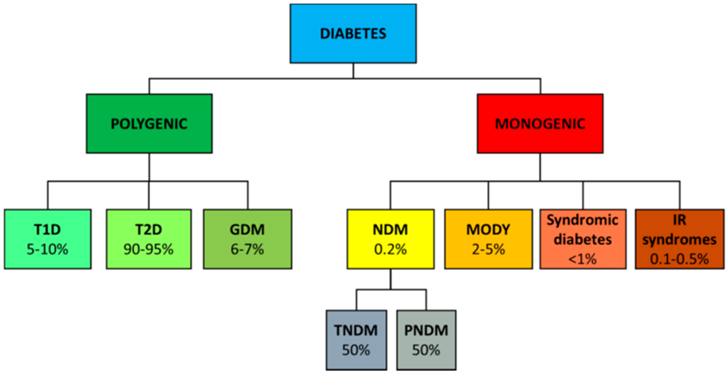
▲ 糖尿病分型示意图,Francesco Liguori et.al,IJMS(2021)
胰岛素分泌不足和胰岛素抵抗是糖尿病发病的根本原因,因此如何使胰岛β细胞恢复胰岛素分泌功能或解除胰岛素抵抗成为了糖尿病研究的首要方向。其中,胰岛β细胞功能保护与再生、代谢通路与系统生物学、免疫调节等是目前糖尿病治疗的热点研究方向。
1. 针对胰岛素分泌不足的I型糖尿病治疗策略
胰岛素分泌不足是I型糖尿病的主要特征,因此补充外源胰岛素是I型糖尿病治疗的经典方法。1992年,弗雷德里克·班廷(Frederick Banting)和查尔斯·贝斯特(Charles Best)从狗胰腺中首次提取了胰岛素并将其用到糖尿病患者身上,开启了糖尿病治疗的新篇章。随后科学家基于测序、结构学等技术深入解析了胰岛素结构,并通过人工手段合成了与人体自身分泌类似的胰岛素,让临床应用更加安全高效。
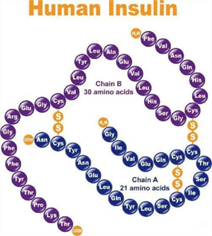
▲ 人工重组胰岛素结构示意图
在I型糖尿病中,机体的免疫系统会错误地将胰岛β细胞上的蛋白识别为外来抗原发起攻击,导致胰岛β细胞受损和功能丧失从而不能分泌胰岛素,因此通过调控自身免疫系统保护胰岛β细胞不受破坏是解决糖尿病分泌不足的策略之一。
另外,胰岛细胞胰岛素分泌功能的恢复也是I型糖尿病患者治疗的重要手段。比如在胰岛β细胞再生与功能保护中,通过调控胰岛素分泌相关基因或生长因子(如PDX1、MAFA)刺激β细胞的增殖或分化,从而促进胰岛β细胞恢复胰岛素分泌功能。
2. 针对胰岛素分泌抵抗的II型糖尿病治疗策略
II型糖尿病的主要表现为胰岛素抵抗,即身体对胰岛素的反应减弱,从而导致胰岛素不能有效地促进葡萄糖的摄取和利用。
以GLP-1为药物靶点的药物治疗是改善胰岛素抵抗的重要方法。GLP-1(胰高血糖素样肽-1)是人体肠道L细胞分泌的多肽激素,通过激活胰岛β细胞表面的GLP-1受体促进胰岛素分泌,实现精准控糖。
常见的GLP-1药物包括二甲双胍、GLP-1受体激动剂等。其中,二甲双胍是改善胰岛素抵抗的首选药物,二甲双胍通过增加GLP-1的分泌减少肝脏和肠道对葡萄糖的吸收,同时增加外周组织细胞对葡萄糖的利用以降低血糖水平,实现血糖的稳定。此外,SGLT-2抑制剂、噻唑烷二酮类也是改善胰岛素抵抗的常见药物。
随着创新技术的不断涌现,糖尿病药物研究领域呈现出蓬勃发展的态势。据SNS Insider最新市场研究报告显示,全球糖尿病药物市场规模预计在2032年突破1450亿美元,2024年至2032年期间的复合年增长率为6.9%。
2024年10月,国际巨头诺和诺德在《Nature》上发表的篇题为“Glucose-sensitive insulin with attenuation of hypoglycaemia”的文章,文章报道了诺和诺德设计了一款可以进行智能调节的胰岛素——NNC2215。
该胰岛素通过在胰岛素分子上引入葡萄糖敏感开关,实现了在低血糖时降低活性、高血糖时增加活性的效果。数据显示NNC2215在葡萄糖浓度从3mM升至20 mM时,胰岛素受体对NNC2215的亲和力增加了3.2倍,证实了其响应血糖水平的变化潜力。此外,研究人员也在大鼠和猪模型中开展试验,进一步评估了NNC2215的安全性和功效。
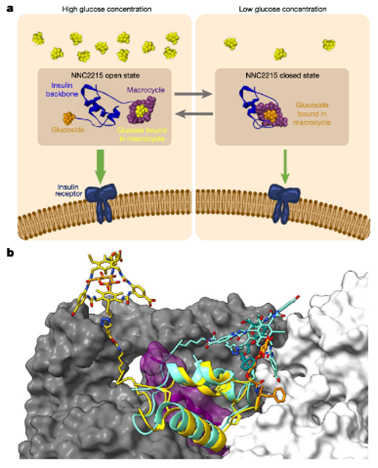
▲ Rita Slaaby et.al, Nature(2024)
目前,我国在糖尿病研究中也取得了较大的进展。2024年6月,我国获批的依柯胰岛素成为了全球首个一周仅需注射一次的胰岛素产品,该药物通过进行创新的分子设计与结构修饰,使其药物半衰期延长至196小时,大大提高了患者的依从性。除了传统的药物和外源依赖的胰岛素治疗,基于干细胞治疗的方法在糖尿病研究进展中也发挥越来越重要的作用。
2024年5月,清华大学医学院在《干细胞转化医学》期刊上发表了一篇题为“间充质干细胞治疗2型糖尿病的临床疗效和安全性”的研究综述。研究回顾了过去五年内6项临床试验的数据,共纳入262名2型糖尿病患者。结果显示,接受间充质干细胞治疗的患者糖化血红蛋白(HbA1c)平均降低32%,空腹血糖(FBG)平均降低45%,胰岛素分泌功能显著改善,且未观察到严重不良事件,该研究证实了间充质干细胞治疗2型糖尿病安全有效。
除了传统的药物治疗方式,新型细胞治疗也正在成为糖尿病治疗的新热点。2025年1月,北大邓宏魁团队在《NatureChemical Biology》上发表的题为“A Rapid Chemical Reprogramming System to Generate Human Pluripotent Stem Cells”的文章,报道了 ipsc诱导胰岛β细胞技术取得的重大突破,发现了化学重编程体系的关键表观遗传障碍,这不仅加速了I型糖尿病的治疗进程,而且实现了最短10天将人体细胞诱导为多能干细胞,随后该团队基于该技术对具有11年病史的I型糖尿病患者进行治疗,随访结果良好,该研究实现了I型糖尿病的临床功能性治愈,为干细胞临床应用带来了更高的稳定性和可靠性。
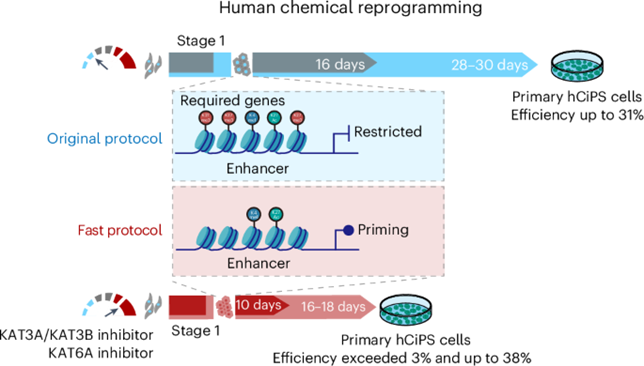
▲ Wang, Y. et al. Nat Chem Biol(2025)
总体来讲,随着技术的发展,糖尿病研究和治疗方案无论是在科研端,还是药物开发、干细胞治疗等领域,其发展都日新月异。下一期,我们将详细介绍糖尿病大分子药物的研发进程。
如需了解更多业务信息欢迎拨打
客服热线电话:400-086-5292
或者扫码咨询我们 ↓↓↓

注:公众号后台回复“糖尿病解决方案”即可获取全文,所有解释权归泉心泉意集团所有。