 来源:
来源:
 2025-08-07
2025-08-07
 323
323

01 什么是糖尿病大分子药物?
Part.1
糖尿病大分子药物包括 GLP-1受体激动剂,胰岛素类药物,融合蛋白和抗体药物,新型多肽类 药物等不同的类型。
GLP-1 受体激动剂是一类模拟胰高血糖素样肽-1 (GLP-1)作用的药物。小肠细胞分泌 GLP-1 肽类 激素后,激活 GLP-1 受体,促进胰岛β细胞分泌胰岛素,抑制胰岛α细胞分泌胰高血糖素,从而实现对血糖的精准调控。
胰岛素类药物是糖尿病治疗的重要手段,主要通过补充外源性胰岛素来降低血糖水平。
根据作用时间的不同,胰岛素类大分子药物可以分为长效胰岛素类似物(代表药物甘精胰岛素(Insulin Glargine)、地特胰岛素(Insulin Detemir)、德谷胰岛素(Insulin Degludec))、速效胰岛素(代表药物门冬胰岛素(Insulin Aspart)、赖脯胰岛素(Insulin Lispro))和双效胰岛素。
糖尿病大分子药物的开发,一般包括靶点发现与验证,药物设计和分子优化,药效验证,生产工艺开发,临床前研究,以及临床研究等阶段。
02 靶点发现与验证
Part.2
以提取胰岛组织的转录组为例,我们简要说明下转录组发现靶点的基本思路:
首先从糖尿病患者与对照正常人中提取胰岛组织的mRNA,随后进行反转录以及PCR扩增制备测序文库后进行NGS测序。获得测序数据后,进行生物信息学分析,通过GO基因功能富集、特异高表达基因分析等方法寻找与糖尿病发生相关的高风险表达基因(如TCF7L2、PPARγ)。
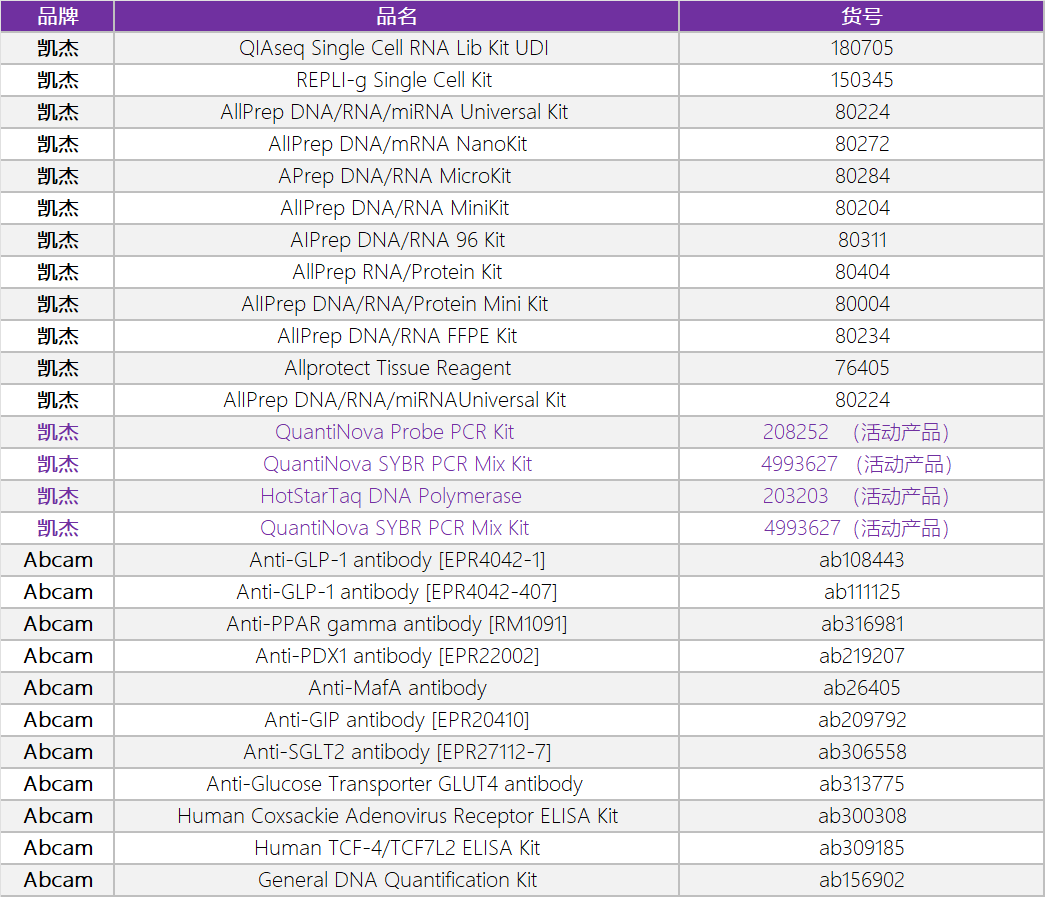
泉心泉意云智慧供应链提供靶点发现与验证阶段的试剂盒,相关产品货号见附录。
03 表达系统的选择
Part.3
选择合适的表达系统能够确保目标蛋白的高产量以及功能的稳定性,常见的表达系统包括大肠杆菌,毕赤酵母、CHO 细胞以及昆虫细胞。以胰岛素生产为例,我们简述其生物发酵法的生产工艺:
大肠杆菌菌株(Escherichia coli) BL-21(DE3)系列菌株是胰岛素表达最常用的菌株之一,适用于无毒异源基因的表达。除了大肠杆菌,酵母菌株(Sacharomyces cerevisiae)和 毕赤酵母(Pithiapastoris)也是常用的表达系统,在糖尿病大分子药物中,赛诺菲的Lantus、礼来的Basaglar、诺和诺德的Novolog均使用大肠杆菌发酵生产,而诺和诺德的Fiasp、Tresiba产品则基于酵母菌系统发酵生产。
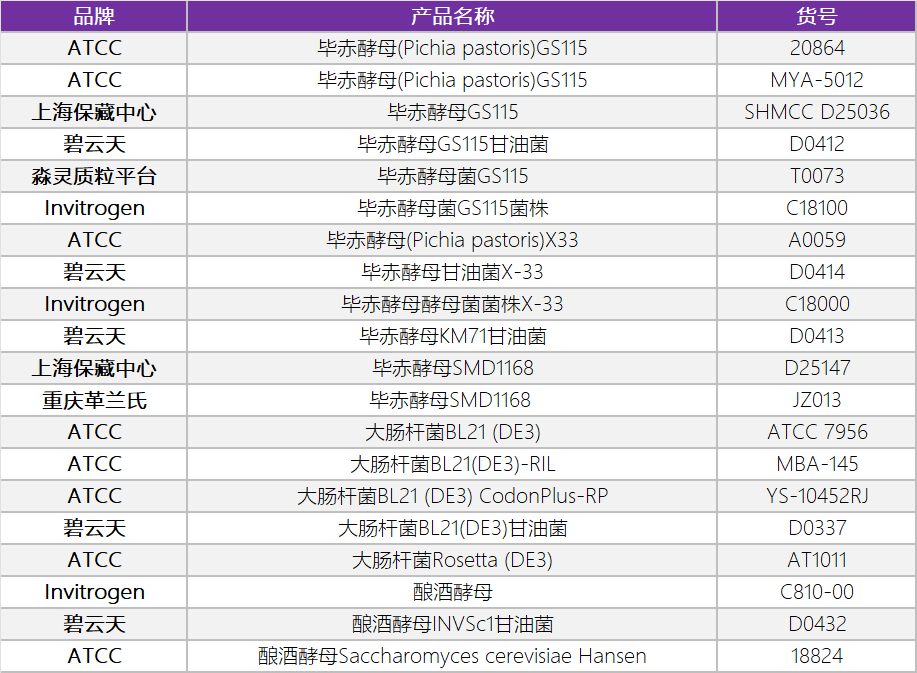
泉心泉意云智慧供应链提供各种大肠杆菌菌株E. coli BL-21 (DE3)、酵母菌株Saccharomyces cerevisiae 和毕赤酵母(Pichia pastoris),相关产品货号见附录。
04 胰岛素表达质粒构建及重组菌株验证过程
Part.4
在基于生物表达系统的胰岛素生产中,往往需要制备表达胰岛素的质粒,并将其导入大肠杆菌中进行批量的生产。胰岛素表达质粒的构建可以通过经典的酶切酶连方法,也可以采用快速组装试剂盒来完成。
在经典的酶切酶连方法中,首先需要选定合适的表达菌株,然后构建带有胰岛素表达基因的表达质粒,主要步骤如下:
目标基因获取:通过基因组文库筛选、RT-PCR扩增或化学合成等方法,获得胰岛素的目标基因。
载体选择与酶切:选择pET表达质粒作为胰岛素基因的载体,使用限制性内切酶对质粒进行切割,使其产生与目标基因末端相匹配的黏性末端。
基因连接:将酶切后的质粒与目标基因片段混合,利用DNA连接酶将二者“缝合”起来,形成可以表达胰岛素的重组质粒。
除了经典的酶切酶连方法外,市面上还有许多质粒快速组装试剂盒可供选择,例如NEB的Gibson Assembly Cloning Kit,其原理是:
基因片段扩增:通过PCR扩增得到末端带有相同序列的基因片段和载体片段。
混合反应:将扩增得到的基因片段和载体片段加入到含有外切酶、聚合酶和连接酶的反应体系中。
组装过程:外切酶在DNA片段的3'末端产生单链突出端,这些突出端与相邻片段的互补序列退火。聚合酶填补退火片段之间的缺口,连接酶封闭组装DNA中的缺口,最终形成完整的双链DNA分子。
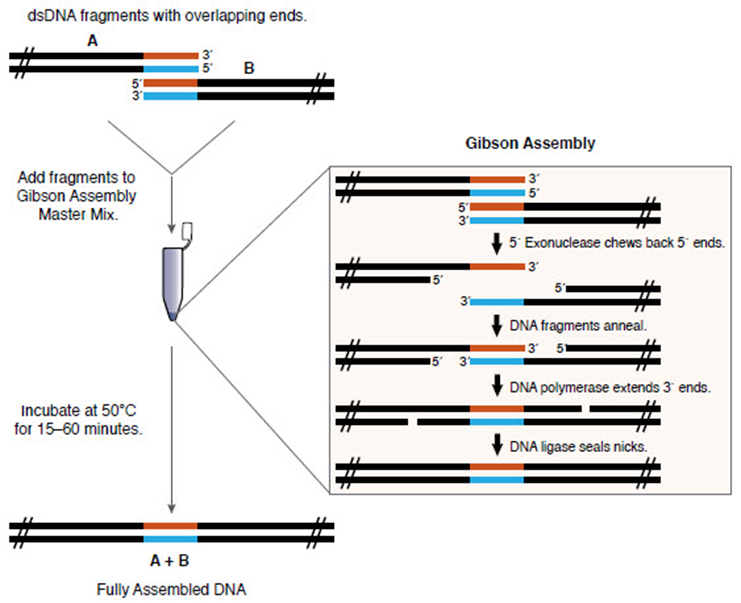
▲Gibson组装克隆方法概述
重组质粒构建完成后,需要将重组环状质粒导入 E. coli BL-21 (DE3)感受态细胞中进行培养,挑选转化后的克隆,抽提质粒并进行序列验证,以确保菌株能够正确表达出胰岛素蛋白质。验证成功后,对获得的可以表达胰岛素的E.coli菌株进行扩大培养。
泉心泉意云智慧供应链提供各种快速组装试剂盒,质粒抽提试剂盒,限制性内切酶、DNA连接酶等,相关产品货号见附录。
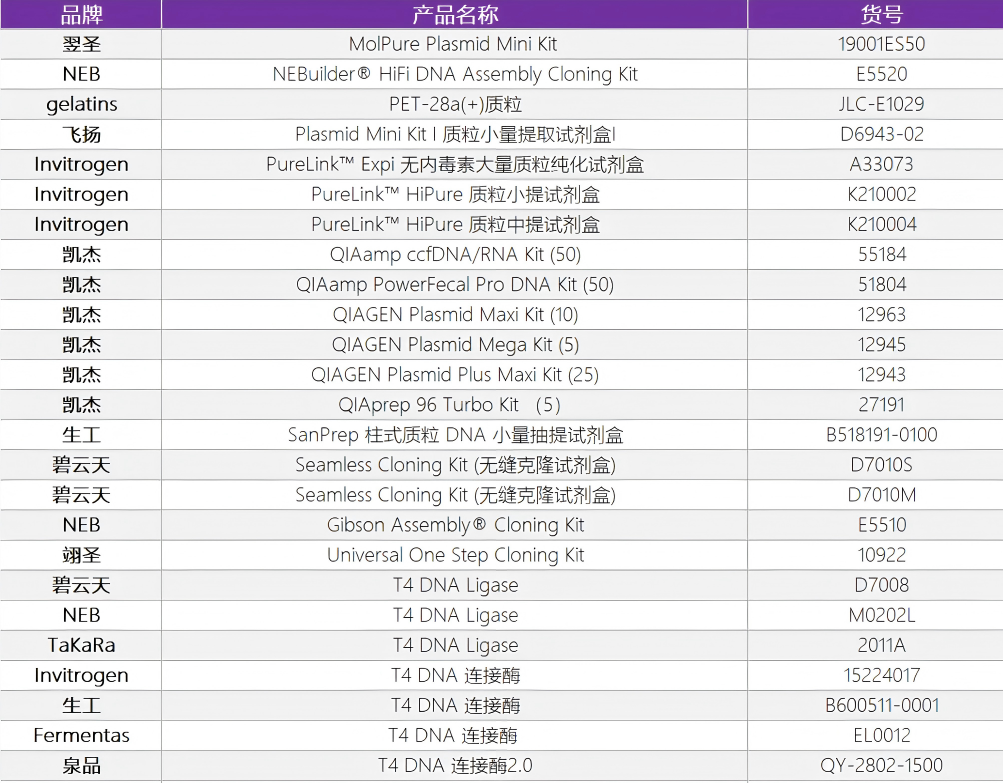
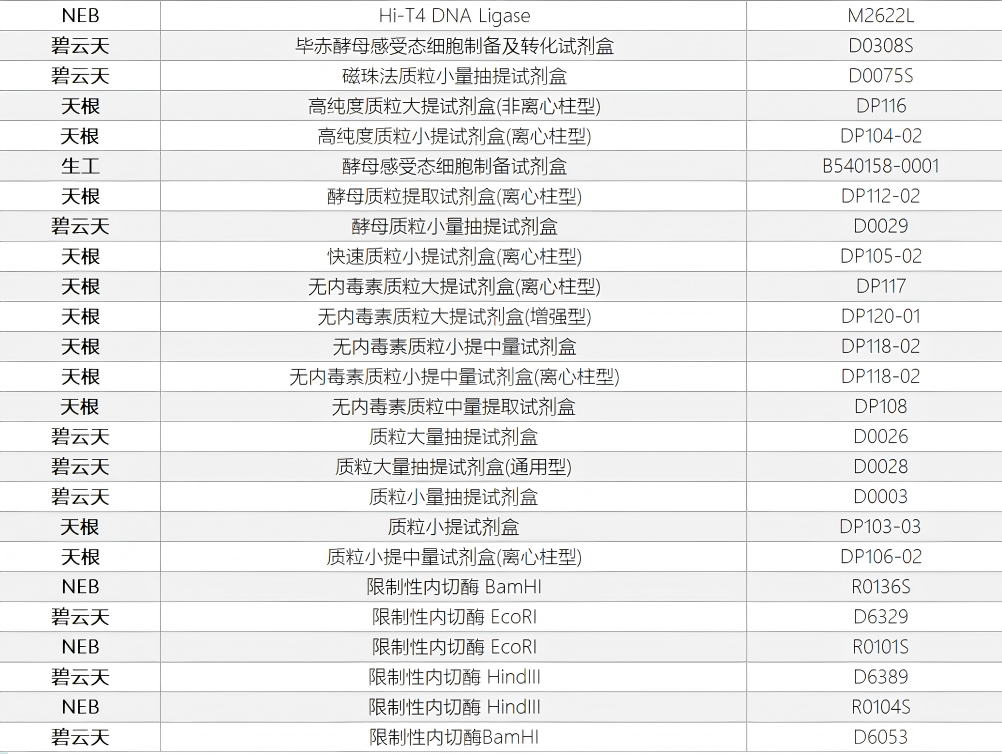
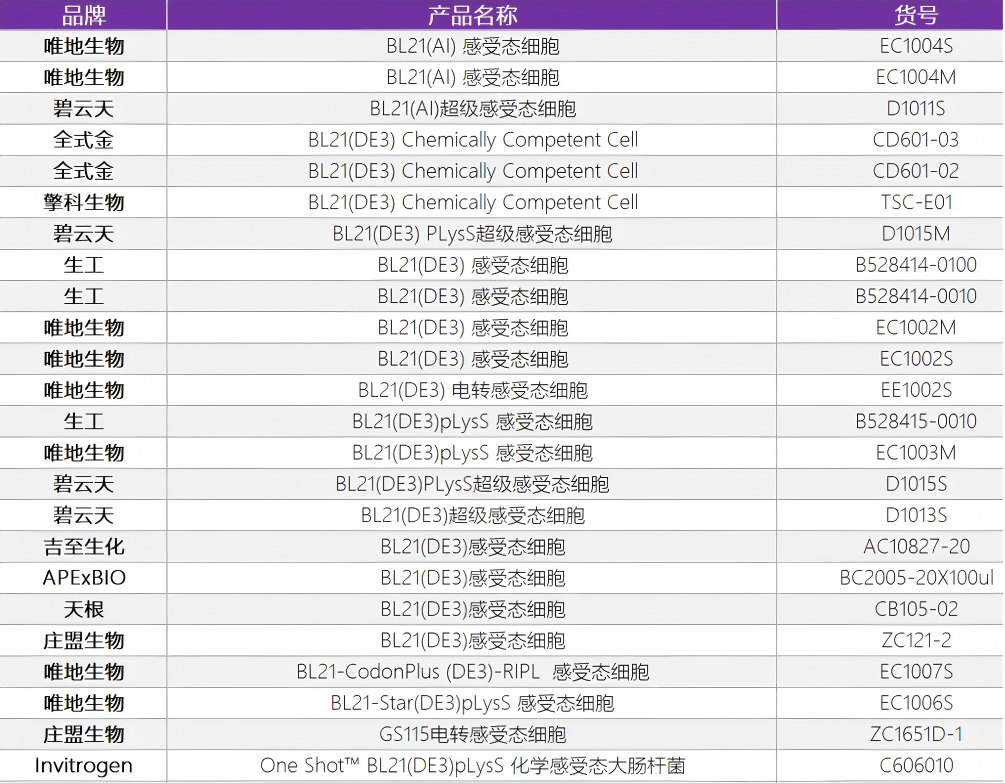
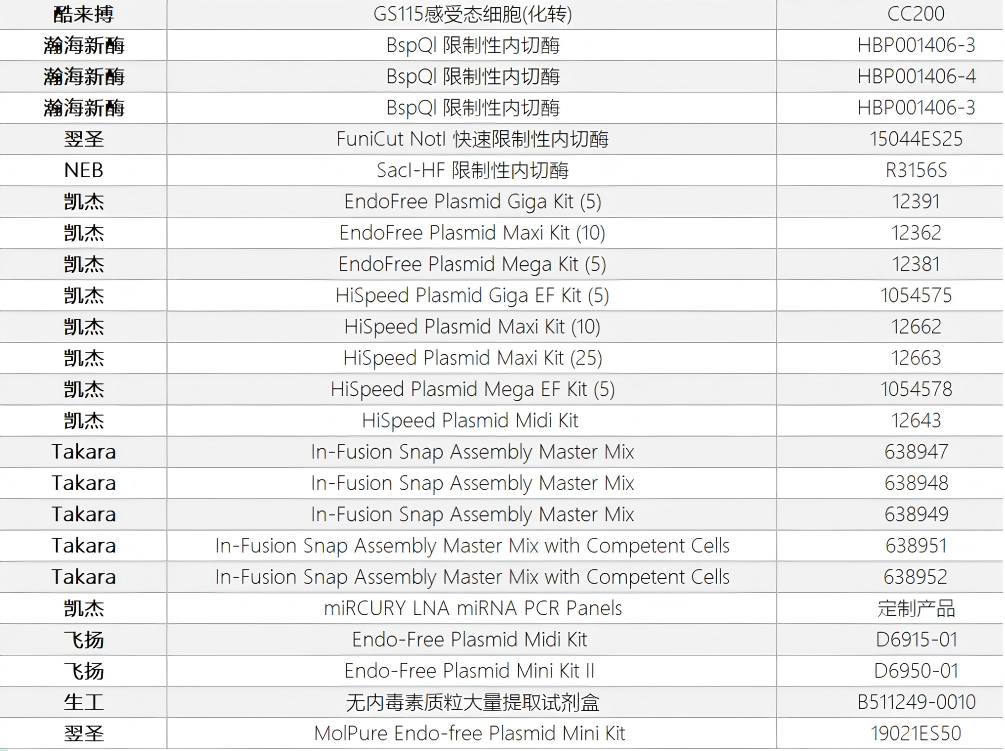
05 小规模发酵和纯化
Part.5
构建完带有糖尿病大分子药物如胰岛素的表达载体菌株后,就可以进入小规模发酵和纯化环节。大肠杆菌生长速度快,培养条件简单,成本较低,比较适合大规模生产。当使用大肠杆菌进行生产时,由于其缺乏真核生物的翻译后修饰机制,因此表达的胰岛素等大分子药物往往需要在后续过程中进行化学修饰,并且其生成的胰岛素前体分子通常是包涵体形式,因此在发酵结束后需要通过细胞破碎、包涵体洗涤、溶解和翻译后修饰等步骤,将前体转化为活性胰岛素。
酵母虽然生长速度相对较慢,但酵母细胞能够进行高效的分泌表达且具有真核生物的翻译后修饰机制,能够进行糖基化、磷酸化等修饰,因此当使用酵母表达系统生产的胰岛素更接近天然的人类胰岛素,可以直接分泌可溶性的胰岛素前体,简化了下游的纯化过程。
发酵过程一般在发酵罐中进行,在发酵过程中需要严格监控和调节温度、PH值、溶氧等参数,确保细胞在一开始处于快速生产,但进入稳定期后能够高质量的产生目标产物。当发酵完成后即可进入纯化环节,纯化主要是为了将发酵后细菌/酵母产生的重组人胰岛素进行提取和纯化。
大肠杆菌表达系统通常使用离心法进行粗提取后,进行离子交换层析、亲和层析(如基于Protein A或Protein G),凝胶过滤色谱,疏水作用层析的方法进行精细纯化。酵母表达系统一般采用离子交换层析、亲和层析、输水层析和凝胶过滤层析等方法进行蛋白的纯化。亲和层析利用protein A与胰岛素的特定结构域进行的特异性结合,实现胰岛素的捕获和纯化;离子交换层析基于胰岛素和杂质的等电点在不同的PH下对离子交换树脂的亲和力不同,达到分离的目的。疏水层析基于胰岛素和杂质在疏水性的差异,在高盐浓度下,胰岛素与疏水层析柱的结合力较弱。凝胶过滤层析主要是基于胰岛素与其他杂质间的分子量大小进行分离,不同分子量的蛋白在凝胶颗粒孔隙的移动速度不同。最后,可以通过质谱分析和SDS-PAGE等方法可以检测获得的胰岛素纯度。
泉心泉意云智慧供应链提供各种蛋白纯化方法的填料等,相关产品货号见附录。
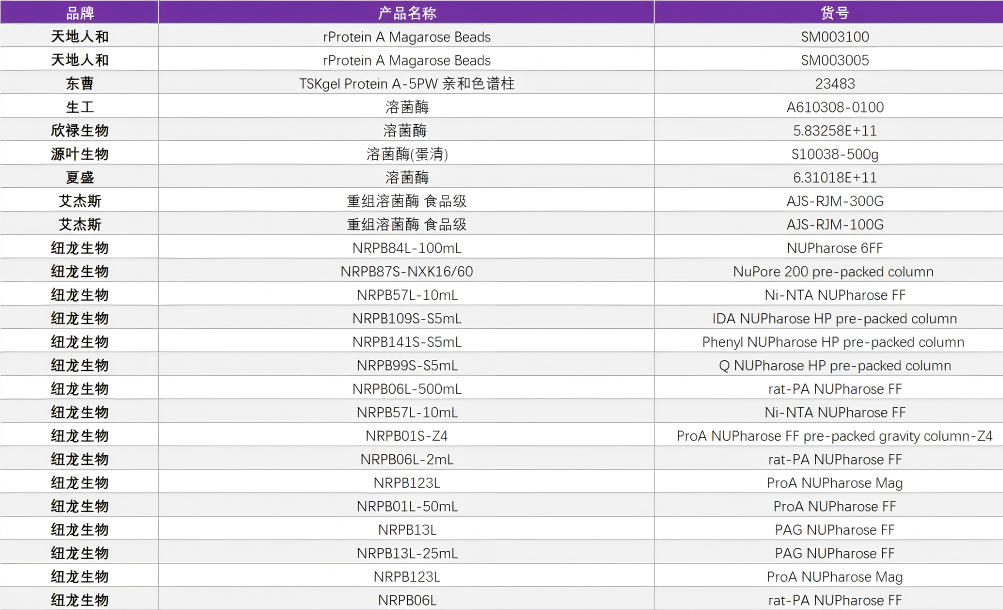
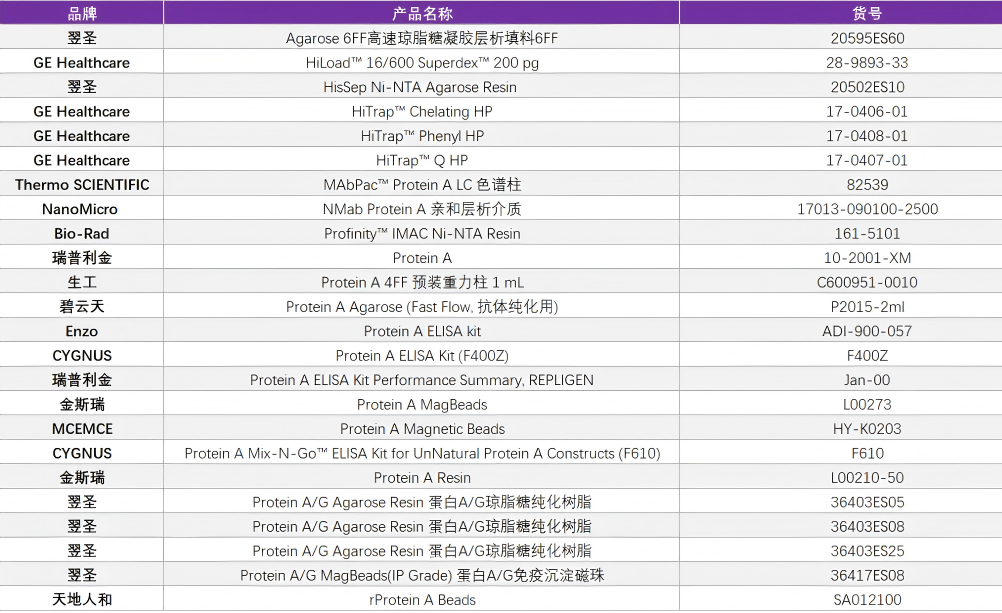
在糖尿病大分子药物研发生产过程中,无论是靶点的选择验证、还是表达系统的选择与质粒构建,以及大分子的纯化等都是药物研发的关键。那么这些药物在被获批前都需要开展哪些功能试验以及毒理学实验呢?我们下期介绍。
如需了解更多业务信息欢迎拨打
客服热线电话:400-086-5292
或者扫码咨询我们 ↓↓↓
