 来源:
来源:
 2025-03-18
2025-03-18
 581
581
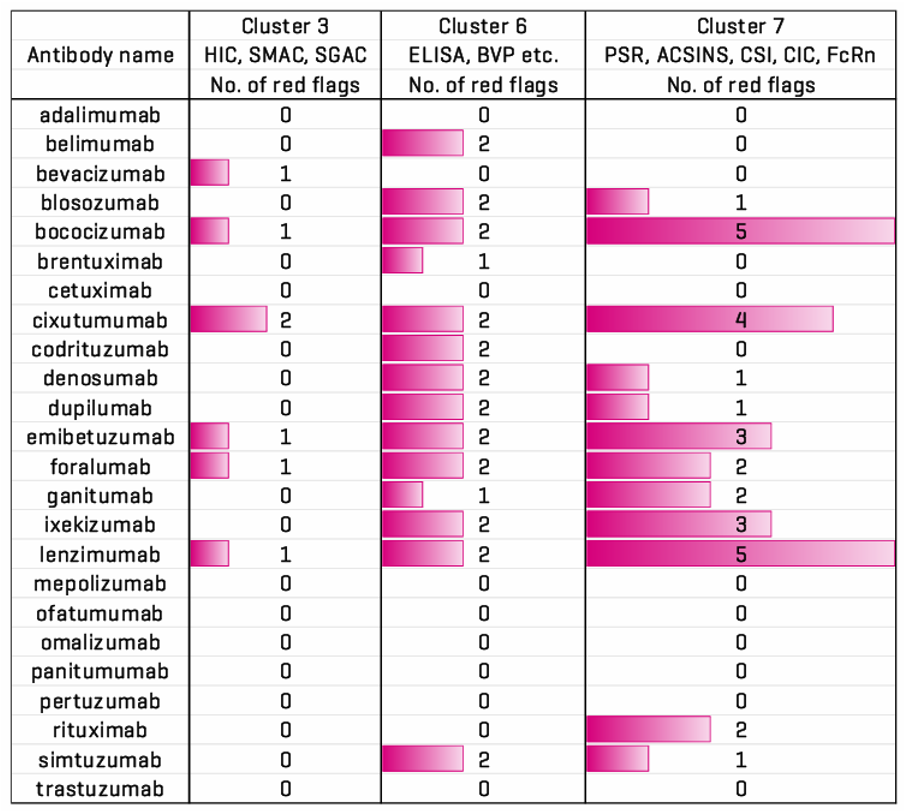
越来越多的证据表明,生物制剂的非特异性和多特异性检测与临床试验的成功与否密切相关,因此其在药物发现和开发中发挥越来越重要的方面。研究表明,表面疏水性和阳性表面斑块是研究中2个不利的分子特征,但尽管如此,目前行业缺乏快速和标准化的方法可以筛选数千个候选物。目前,许多药物开发者使用酶联免疫吸附测定(ELISA)或者色谱法进行检测,但是这两种方法却也存在许多弊端,更多信息可参考前面讲到的方法检测对比(点击查看详情)。
PAIA基于微孔板技术提出了一系列高通量检测方法。简单讲,通过化学定义的bead检测药物候选物与疏水性(HIC-ike)和带负电荷(CEX-ike)表面的结合情况,进而评估其非特异性;使用包有卵白蛋自(OVA)的bead进行多特异性预测;使用包有肝素的bead(HEP)检测胞饮作用。
这些检测方法在PAIA的专用底部凸起微孔板中进行,可以在<45min内完成多达384个样本的检测。此外,使用的试验器材也极其简单,只需要一个微板摇床和一个具有底部读能力的荧光板读数器就可以完成这项高通量检测。

图1.PAIA检测原理图
PAIA微板上的测定工作流程
整个测定过程在384孔PAIA板中进行,该板内装有干燥的捕获bead。在加入荧光纳米抗体和样品后,板子摇晃30min,bead沉淀在底部从而离开检测荧光信号的区域,随后用可以进行底部读取的荧光板读数器读取。该读数仅检测溶液中的荧光信号。
图2.非特异性和多特异性测定中的测定组分:不同的捕获bead被描绘为灰色圆圈,可以与抗体结合。通过荧光标记的纳米抗体(蓝色正方形)检测,其对抗体的Fc域具有高亲和力。
目前,所有抗体(HIC、OVA、CEX)都通过PAIA测试进行分析,并与已发表的数据以及内部色谱结果进行比较。此外,PAIA测试了不同浓度的抗体,以确定测试范围。
简而言之,将samples稀释在 Dl water到 10 ug/mL and 20 uL/ml浓度的溶液中,将samples分配到384 PAIA孔板中。随后,加入40pL荧光标记纳米体,在轨道摇床上以2200rpm摇动微板30 min。之后,500xg快速离心PAIA孔板,并以640/670nm波长在板读取器上的底部读取数据。
01 Hydrophobic interaction assay (HIC)
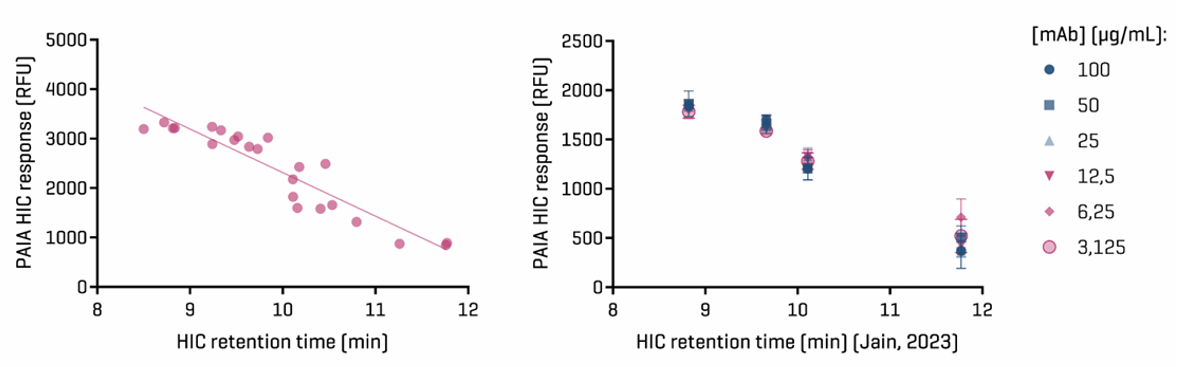
图3.HIC测定结果与已发表的数据的比较:左图:所有24种单克隆抗体的荧光强度与已发表的HIC数据(来自Jain等人2023年)图。相关性较好,所有疏水的单克隆抗体都被成功识别为高结合物(具有低荧光信号)。右图:四种单克隆抗体在不同浓度下进行分析,表明在这一范围内,该测定是浓度无关的。
02 Cation exchange assay (CEX)
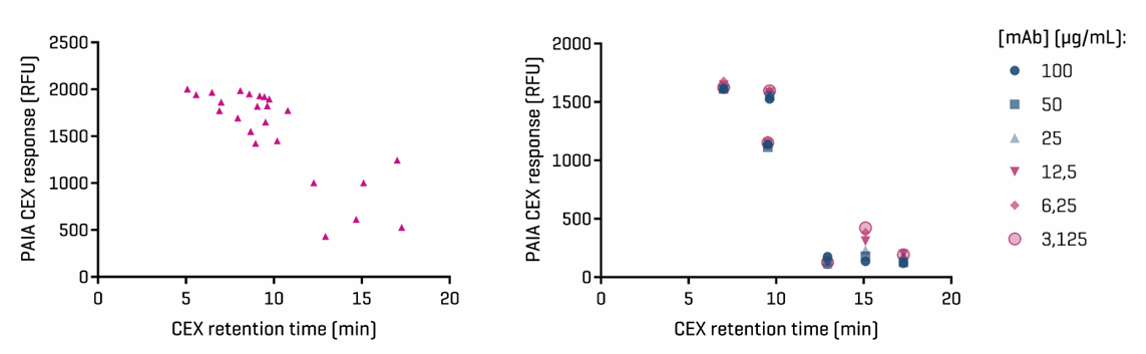
图4.CEX测定结果与内部CEX数据的比较:左图:所有24种单克隆抗体的荧光强度与内部CEX色谱分析结果图。右图:六种单克隆抗体在不同浓度下进行分析,表明在3至100 ug/ml的范围内,该测定方法在浓度上不敏感。因此,在筛选前,样品无需进行滴度标准化。
03 Ovalbumin binding assay (OVA)
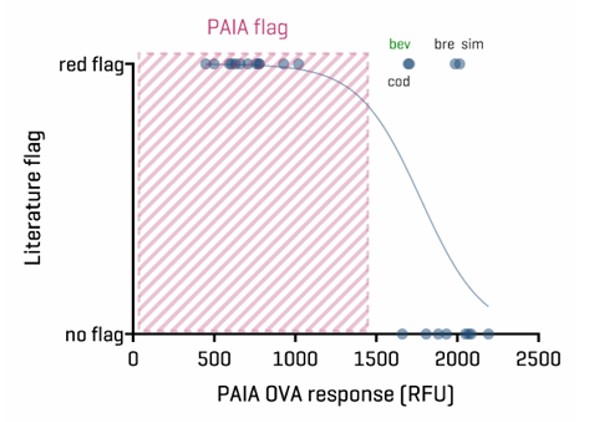
图5.卵白结合结果与文献中PSR标记的比较所有24种单克隆抗体的测定结果从<500到>2000不等。所有强度<1500的单克隆抗体都被认为是卵白结合物。这些分子在Jain等人研究中都被标记为红色,这意味着它们在表1中列出的测定簇中存在问题。具有高强度的单克隆抗体是非结合物,这与文献中的情况相符。
04 Heparin binding assay (HEP)
肝素色谱法被用作内皮细胞上高度负电荷糖衣的替代物,这些糖衣参与非特异性清除【Kraft等人,2020年3月】。
PAIA Biotech使用肝素化珠粒在化学定义限定的缓冲条件和盐浓度下研究Mab面板的肝素结合。
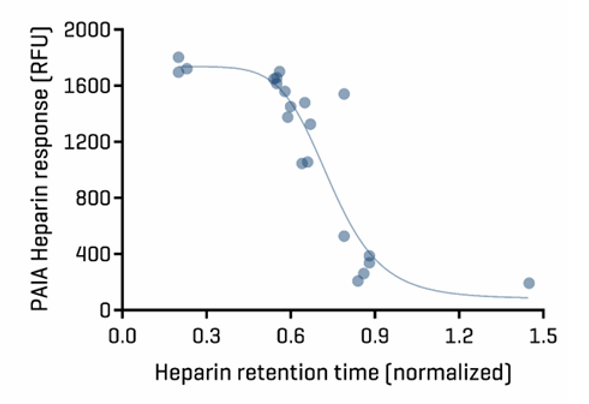
图6.肝素结合测定结果与已发表数据的比较肝素结合测定正确地识别了非结合物(高荧光强度)和强结合物Lenzilumab(低荧光)。其余Mabs的值与发表的肝素色谱数据呈准线性相关。